科研团队
当前您的位置: 正文专家点评 | Science 突破!河南大学王学路团队解析大豆根瘤能量感受及碳源分配调控共生固氮的新机制
发布日期:2022-12-02 浏览量:
氮素是植物生长发育必须的大量营养元素,是生物体中蛋白质和核酸等分子的重要组成部分。尽管地球大气中含有78.1%的氮气,但不能被绝大部分植物直接利用,因此农业生产高度依赖工业氮肥。然而,氮肥的生产需要大量的化石燃料,并且过度施用氮肥会造成土壤板结退化和水体污染,影响农业的可持续发展。生物固氮是自然界生物可用氮的最大天然来源,豆科植物与根瘤菌可以相互作用形成一个独特的器官,即共生根瘤。在根瘤中的共生固氮是地球生态系统中氮气还原为可被植物利用的氨的重要途径,每年贡献了60%以上的陆地生物固氮量,影响着农业和自然生态系统中的初级生产和碳汇,为减少对工业氮肥的依赖,发展绿色农业具有重要意义。共生固氮是一个高耗能的酶催化过程,植物本身光合作用固定的碳水化合物是共生固氮最主要的碳源和能量来源(图1)。因此,共生根瘤的固氮能力需要与豆科植物的碳源和能量水平相协调,以平衡共生固氮和其它生命过程的碳消耗和保证豆科植物在不同环境下的正常生长。然而,人们并不清楚豆科植物如何响应碳源和能量水平从而调控高耗能的生物固氮过程。
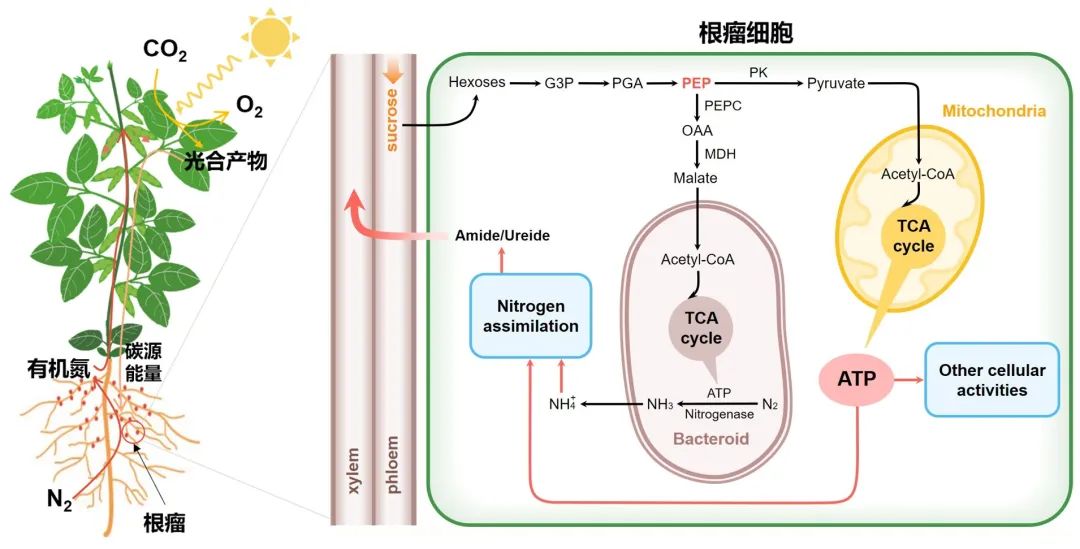
图1:共生固氮中碳源和能量的来源及分配
2022年12月2日,河南大学省部共建作物逆境适应与改良国家重点实验室王学路团队在Science上发表了题为Phosphoenolpyruvate reallocation links nitrogen fixation rates to root nodule energy state的研究长文,发现了大豆根瘤能量状态调控共生固氮的新机制。在根瘤碳源供应增加时,根瘤能量状态上升,该研究发现了新的能量感受器蛋白GmNAS1(soybean nodule AMP sensor 1)和GmNAP1(GmNAS1-associated protein 1)感受上升的能量状态,进而调控糖酵解中间产物磷酸烯醇式丙酮酸(Phosphoenolpyruvate, PEP)在大豆根瘤细胞中的分配方向,促进PEP转化为苹果酸为共生体供能从而增强固氮能力(图1)。

豆科植物根瘤固氮能力随环境变化而受到影响,在外界氧气和磷营养供应改变时,根瘤的固氮能力会进行迅速地调整,而此时根瘤的能量状态也会发生相应的变化,表明根瘤能量状态的变化可能是固氮能力改变的重要诱因 (Ching, 1976;Sa et al., 1991)。胱硫醚β合成酶(Cystathionine β-synthase,CBS)结构域是一类具有结合腺苷酸及其衍生物(包括AMP、ADP和ATP等)能力的保守功能域, CBS家族蛋白具有作为细胞能量感受器的潜力,如动物和酵母中的AMPK(Baykov et al., 2011;Gonzalez et al., 2020)。为了鉴定大豆根瘤中能量状态的感受器,作者筛选了71个CBS家族蛋白,鉴定到在根瘤中特异高表达的GmCBS22(GmNAS1)和GmCBS14(GmNAP1)。遗传分析发现,GmNAS1和GmNAP1功能缺失后不影响根瘤的形成和发育,但是完全抑制了根瘤碳源供应增加后固氮能力的上升。进一步研究发现,GmNAS1和GmNAP1通过感知细胞AMP水平来监测根瘤细胞能量状态, GmNAS1可以直接结合AMP从而与GmNAP1在线粒体膜上形成异源二聚体,在碳源供应增加导致根瘤能量状态上升时,AMP含量降低,促使GmNAS1-GmNAP1异源二聚体解离,形成GmNAS1-GmNAS1和GmNAP1-GmNAP1同源二聚体。
光合产物以蔗糖的形式运送到根瘤之后,经过糖酵解途径生成中间产物PEP,之后PEP可以经过磷酸烯醇式丙酮酸羧化酶(PEPC)和苹果酸脱氢酶(MDH)催化生成苹果酸为类菌体的固氮反应提供能量,也可以在丙酮酸激酶(PK)的催化下生成丙酮酸进入线粒体的三羧酸循环而产生ATP(图1)。碳源供应上升的高能状态下,GmNAS1/GmNAP1-GmNFYC10调控元件抑制PK基因转录,进而减少了PEP向丙酮酸的转化,使更多PEP转化为草酰乙酸和苹果酸,从而增强类菌体的碳源供应和根瘤固氮能力(图2)。
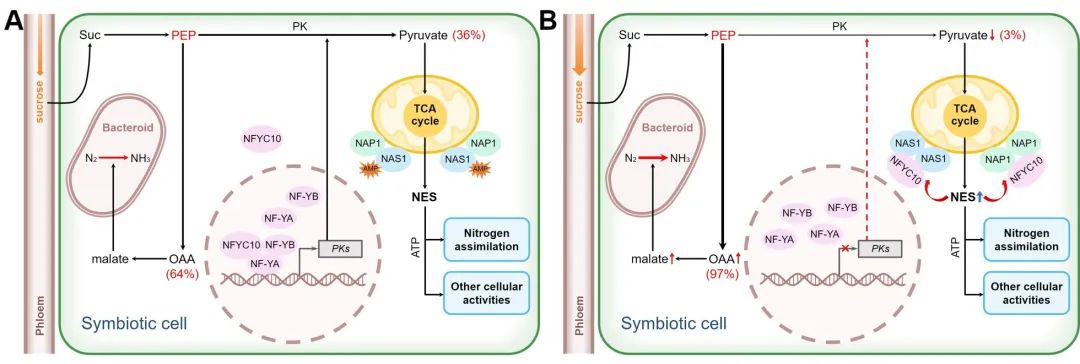
图2:根瘤中的新能量感受器调节PEP分配而协同调控碳源水平和固氮能力
参考文献:
[1] T. M. Ching, Regulation of nitrogenase activity in soybean nodules by ATP and energy charge. Life Sci. 18, 1071-1076 (1976).
[2] T. M. Sa, D. W. Israel, Energy status and functioning of phosphorus-deficient soybean nodules. Plant Physiol. 97, 928-935 (1991).
[3] A. A. Baykov, H. K. Tuominen, R. Lahti, The CBS domain: a protein module with an emerging prominent role in regulation. ACS Chem. Biol. 6, 1156-1163 (2011).
[4] A. Gonzalez, M. N. Hall, S. C. Lin, D. G. Hardie, AMPK and TOR: The Yin and Yang of Cellular Nutrient Sensing and Growth Control. Cell Metab. 31, 472-492 (2020).
[5] T. Wang et al., Light-induced mobile factors from shoots regulate rhizobium-triggered soybean root nodulation. Science 374, 65-71 (2021).
[6] B. Zhang et al., Glycine max NNL1 restricts symbiotic compatibility with widely distributed bradyrhizobia via root hair infection. Nature plants 7(1), 73–86 (2021).
[7] C. He et al., GSK3-mediated stress signaling inhibits legume-rhizobium symbiosis by phosphorylating GmNSP1 in soybean. Mol. Plant 14, 488-502 (2021).
[8] W. Fan et al., Rhizobial infection of 4C cells triggers their endoreduplication during symbiotic nodule development in soybean. New Phytol. 234(3):1018-1030 (2022).
专家点评
杨维才 院士 (中国科学院遗传与发育生物学研究所)
S. Roy et al., Celebrating 20 years of genetic discoveries in legume nodulation and symbiotic nitrogen fixation. Plant Cell 32(1), 15–41 (2020).
T. Wang et al., Light-induced mobile factors from shoots regulate rhizobium-triggered soybean root nodulation. Science 374, 65-71 (2021).
B. N. Taylor et al., Light regulates tropical symbiotic nitrogen fixation more strongly than soil nitrogen. Nature Plants 4(9), 655–661 (2018).
T. M. Ching, Regulation of nitrogenase activity in soybean nodules by ATP and energy charge. Life Sci. 18, 1071-1076 (1976).
T. M. Ching et al., Energy state and dinitrogen fixation in soybean nodules of dark-grown plants. Plant Physiol. 55, 796-798 (1975).
专家点评
豆科植物与根瘤菌形成的共生根瘤是新进化出的高耗能器官,豆科植物如何在不同能量状态下,在保证植物细胞正常生命活动需要的基础上,合理调控碳源分配用于高耗能的固氮还原反应的分子机制所知甚少。ATP是细胞生命活动的能量载体,其通过水解为ADP或AMP为细胞供能。细胞如何感知能量状态而调节自身代谢过程意义重大。AMP激活的蛋白激酶(AMP-activated protein kinase,AMPK)是目前发现的动物和酵母中主要的感知细胞能量水平的蛋白复合物,AMPK由催化亚基α、调节亚基β和γ组成,其中γ亚基上的胱硫醚β合成酶(Cystathionine β-synthase,CBS)结构域可逆地结合AMP、ADP和ATP,从而可以监测细胞的能量状态。当营养和能量缺乏时,细胞中ATP水平降低,AMP水平升高并与AMPKγ亚基结合,激活AMPK蛋白激酶活性,从而启动下游信号途径以应对细胞能量胁迫(Xiao et al., 2007;Gonzalez et al., 2020)。植物中,AMPK的同源蛋白SnRK1虽然也是响应营养和能量缺乏的主要因子,但目前的研究发现其并不能直接感受细胞中AMP浓度,而主要感受磷酸糖类,在6-磷酸海藻糖含量的降低时被激活(Crozet et al., 2014;Broeckx et al., 2016)。植物共生根瘤中是否存在可以直接感知细胞能量状态的能量感受器仍是一大谜题。
近日,河南大学王学路教授团队通过生化和遗传手段在大豆中鉴定到一对可以直接感受植物根瘤细胞能量状态,进而调控共生固氮能力的能量感受器GmNAS1和GmNAP1,从而回答了这一领域的关键问题。与AMPKγ亚基类似,GmNAS1和GmNAP1也具有四个串联的CBS结构域,在低能状态下,GmNAS1通过CBS结构域结合AMP从而与GmNAP1形成异源二聚体,而在根瘤能量状态上升时,AMP浓度的下降会促使AMP与GmNAS1解离,促进GmNAS1形成同源二聚体,此时GmNAP1也偏向形成同源二聚体。同源二聚化的GmNAS1和GmNAP1可以与一个关键转录因子GmNFYC10a相互作用并将其锚定到线粒体上,减少GmNFYC10a的细胞核积累,从而抑制丙酮酸激酶基因的转录,减少糖酵解中间产物PEP向丙酮酸的转化,使得更多PEP转化为草酰乙酸和苹果酸,增加类菌体的碳源供应来满足生物固氮的高耗能需求。这项突破性研究成果于2022年12月2日以长文发表在Science杂志上。
该研究首次揭示了植物中可直接感受细胞能量状态来调节细胞内碳代谢分配过程的能量感受器蛋白。与哺乳动物AMPK感受能量状态降低不同,GmNAS1和GmNAP1主要感受根瘤细胞能量状态的上升而发挥功能。此外,由于哺乳动物细胞中AMP和ADP的浓度远低于ATP(AMP: 0.5-5 μM, ADP: 50-200 μM, ATP: 3000-8000 μM),AMPK需要可逆地结合AMP和ATP 以测定AMP/ATP比例,从而监测细胞能量状态(Veech et al., 1979;Hellsten et al., 1999;McConell et al., 2005);而该研究发现大豆根瘤细胞中ATP浓度大约分别只有AMP和ADP浓度的10倍和2倍,AMP浓度变化可以显著影响根瘤细胞的腺苷酸能荷,因此GmNAS1主要结合AMP,微弱结合ADP而不需结合ATP就可以监测根瘤细胞的能量状态。这表明动物细胞和植物细胞采用各具特色的分子机制感受能量。
这项突破性进展,为发掘自主产生碳源的植物中更多的能量感受器并建立其信号通路提供了范例,将极大促进对细胞和个体水平碳源分配和代谢调控的进化和分子机制的解析。
参考文献:
B. Xiao, R. Heath, P. Saiu, F. C. Leiper, P. Leone, C. Jing, P. A. Walker, L. Haire, J. F. Eccleston, C. T. Davis, S. R. Martin, D. Carling, S. J. Gamblin, Structural basis for AMP binding to mammalian AMP-activated protein kinase. Nature 449, 496-500 (2007).
A. Gonzalez, M. N. Hall, S. C. Lin, D. G. Hardie, AMPK and TOR: The Yin and Yang of Cellular Nutrient Sensing and Growth Control. Cell Metab. 31, 472-492 (2020).
P. Crozet, L. Margalha, A. Confraria, A. Rodrigues, C. Martinho, M. Adamo, C. A. Elias, E. Baena-González, Mechanisms of regulation of SNF1/AMPK/SnRK1 protein kinases. Front. Plant Sci. 5, 190 (2014).
T. Broeckx, S. Hulsmans, F. Rolland, The plant energy sensor: evolutionary conservation and divergence of SnRK1 structure, regulation, and function. J. Exp. Bot. 67, 6215-6252 (2016).
R. L. Veech, J. W. Lawson, N. W. Cornell, H. A. Krebs, Cytosolic phosphorylation potential. J. Biol. Chem. 254, 6538-6547 (1979).
Y. Hellsten, E. A. Richter, B. Kiens, J. Bangsbo, AMP deamination and purine exchange in human skeletal muscle during and after intense exercise. J. Physiol. 520, 909-920 (1999).
G. K. McConell, R. S. Lee-Young, Z. P. Chen, N. K. Stepto, N. N. Huynh, T. J. Stephens, B. J. Canny, B. E. Kemp, Short-term exercise training in humans reduces AMPK signalling during prolonged exercise independent of muscle glycogen. J. Physiol. 568, 665-676 (2005).
(文章来源:BioArt植物)


